2025年8月1日,苏州大学神经科学研究所刘耀波教授团队最新成果以“Precise Rewiring of Corticospinal Axons and Spinal Interneurons via Near- Infrared Optogenetics for Spinal Cord Injury Treatment”为题在线发表于国际知名期刊Science Advances(一区,Top期刊,NatureIndex收录期刊。2025 IF:12.5)。

利用神经递质谷氨酸修饰的Glu-UCNP介导的非侵入性近红外光遗传学调控技术促进脊髓损伤后脑-脊髓神经环路结构与功能重建
脊髓损伤(Spinal Cord Injury, SCI)是一种严重的中枢神经系统创伤性损伤,尽管在脊髓损伤的治疗方面已取得了诸多进展,但目前仍未找到能够完全治愈脊髓损伤的临床药物或技术。脊髓损伤的完全恢复需要精确重建复杂的神经环路,尤其是在恢复长距离投射轴突与靶向突触后神经元之间的连接方面,目前仍面临巨大挑战。大脑运动皮层中的皮质脊髓束神经元发出下行皮质脊髓束(Corticospinal Tract, CST)神经轴突投射到脊髓,靶向连接脊髓中的突触后中间神经元,将大脑皮层的运动指令传递至脊髓,调节脊髓中间神经元的活动,并进一步激活脊髓运动环路,发挥关键的随意运动(Voluntary Movement)控制作用。CST轴突的损伤会导致脑-脊髓投射的运动控制功能丧失,而精确重建CST轴突与脊髓靶神经元之间的连接,对恢复运动功能至关重要。然而,如何针对特定类型突触精确地重建CST轴突与靶神经元之间功能性神经连接,仍是脊髓损伤治疗中的核心问题。
光遗传学技术能够在单细胞甚至亚细胞层面实现精准的神经环路调控,为神经环路的精确重建提供了前所未有的可能性。结合传统电生理方法,光遗传学工具已广泛应用于揭示长距离投射神经元的作用靶点及其环路机制,同时在运动调控方面展现出巨大的潜力。然而,传统体内光遗传学应用通常需要将光纤植入脑或脊髓组织,尽管能够实现深度刺激,但这种侵入性手术可能对动物带来其它风险,影响其行为表现,并限制了该技术的应用范围。
为解决这一问题,研究团队提出了基于上转换纳米颗粒(Upconversion nanoparticles, UCNP)的非侵入性光遗传学调控策略。UCNP 能将近红外(Near-infrared, NIR)光转换为可见光,利用近红外光对组织的较强穿透能力,从而在无需侵入性手术的情况下实现深部组织的远程光遗传学刺激。更重要的是,UCNP 表面可通过特定神经递质进行修饰,精准靶向特定类型的神经元,从而实现近红外光遗传学工具对特定神经元类型的靶向调控。
在本研究中,研究团队构建了谷氨酸(Glutamate, Glu)修饰的UCNP(Glu-UCNP),实现了对SCI后CST轴突再生和神经环路功能恢复的精准调控。该系统利用了CST神经元是谷氨酸能神经元的特性,CST投射到脊髓后主要与中间神经元连接,因此这些受CST支配的脊髓神经元主要为谷氨酸能突触的突触后中间神经元(即表达谷氨酸受体的脊髓中间神经元)。该系统通过在CST神经元中表达光敏感通道蛋白(Channelrhodopsin 1, ChR1),与脊髓中特异性摄取Glu-UCNP的谷氨酸能突触后中间神经元相配合,从而实现CST与靶神经元之间的精准连接重建(图1)。
在此过程中,Glu-UCNP扮演了双重功能:一方面,移植到SCI后脊髓特定区域的Glu-UCNP能够靶向脊髓中谷氨酸能突触的突触后神经元(通过与表达谷氨酸受体的脊髓中间神经元结合并被内化),另一方面,当NIR光照射脊髓特定区域时,它充当内部光转换器,将NIR光转化为可激活CST中ChR1的可见光。这一光转换过程激活了表达ChR1的受损或残留CST轴突再生,并引导其朝向脊髓中谷氨酸能突触的突触后中间神经元(包括V2a中间神经元)重连,从而重塑了脑-脊髓中枢运动环路(图1)。
本研究通过活细胞成像、脑-脊髓神经环路病毒示踪、脊髓组织免疫荧光染色等实验手段,观察到Glu-UCNP介导的NIR光遗传学调控技术不仅促进了损伤CST轴突的再生,还引导其与谷氨酸能突触后中间神经元(包括V2a神经元)精确连接(图2)。通过体内钙离子检测和前肢精细运动取食实验验证了该策略对于功能重建的有效性(图3)。这些结果进一步表明,Glu-UCNP介导的NIR光遗传学调控技术促进了SCI后脑-脊髓神经连接的结构和功能重塑,进而有助于改善脊髓损伤引起的运动功能障碍。研究人员进一步通过对激活CST神经元的单细胞转录组测序,揭示了Glu-UCNP介导的NIR光遗传学调节过程中,CST轴突再生相关分子网络的动态变化。这些发现不仅验证了该方法重建脑-脊髓精确连接的可行性,也为中枢神经系统损伤的临床治疗手段提供了有价值的研究基础。
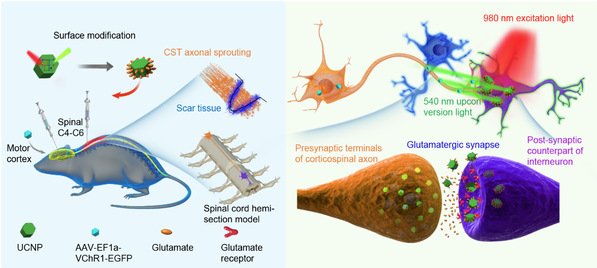
图1 Glu-UCNP介导的NIR光遗传学调控技术促进脊髓损伤后CST轴突与谷氨酸能突触后中间神经元重新连接的示意图。
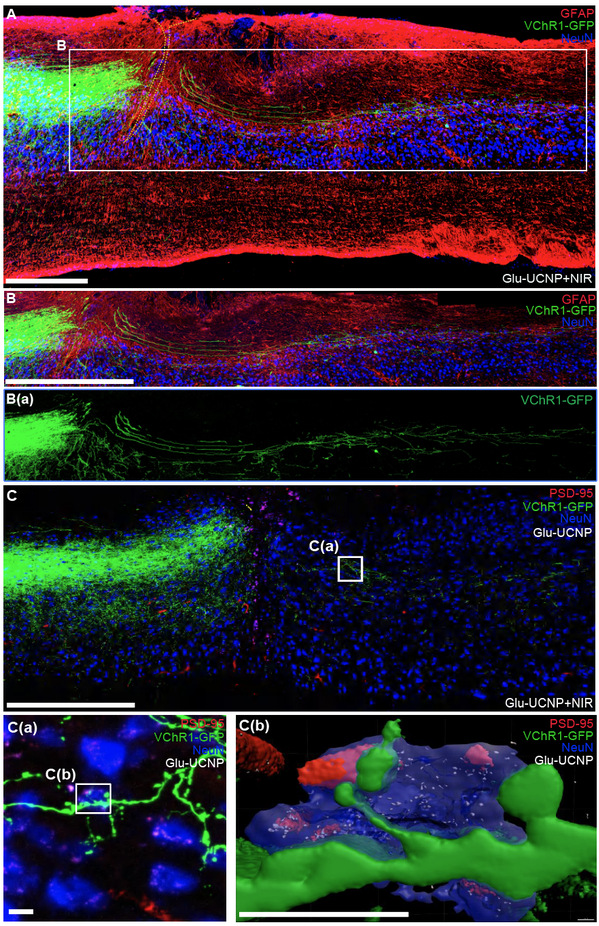
图2Glu-UCNP介导的NIR光遗传学调控技术促进脊髓损伤后CST轴突芽生并与脊髓谷氨酸能突触后中间神经元形成突触连接。
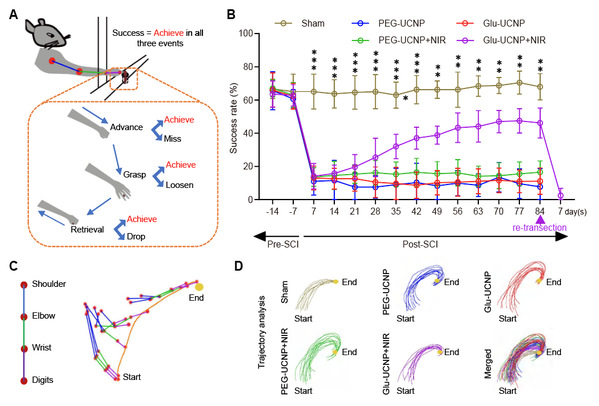
图3Glu-UCNP介导的NIR光遗传学调控技术促进颈段脊髓损伤后前肢取食运动功能的恢复。
苏州大学神经科学研究所刘耀波教授为该文章的最后通讯作者,苏州大学功能纳米与软物质学院的刘坚教授为文章的共同通讯作者,苏州大学神经科学研究所的博士研究生吉喆为本文的第一作者,苏州大学功能纳米与软物质学院的博士后严俊为本文的共同第一作者。该研究获得了国家自然科学基金、国家重点研发计划、江苏省重点研发计划、江苏省高等学校优势学科建设工程等科研项目的资助。
刘耀波教授团队长期从事脑-脊髓中枢神经环路构建以及损伤修复的研究工作,致力于中枢神经再生的分子细胞调控机制和干预靶点、以及神经信号调控中枢神经环路重建的机制和关键技术的转化神经科学研究。在Nat Neurosci、Nat Commun、 Sci Adv 、EMBO J、Cell Res、Cell Discov、Adv Funct Mater等期刊发表系列研究论文,并获得中国及美国专利授权9项。课题组长期招聘博士后,待遇从优,欢迎垂询。
原文链接:https://www.science.org/doi/10.1126/sciadv.ads4938
参考文献:ZheJi,JunYan,ChenxiLi,et al.Precise Rewiring of Corticospinal Axons and Spinal Interneurons via Near-Infrared Optogenetics for Spinal Cord Injury Treatment.Sci. Adv.11(31), eads4938(2025).
